وبلاگ

اسید بنزوئیک چیست؟
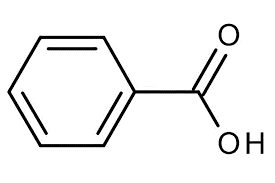
اسید بنزوییک، با فرمول شیمیایی C₆H₅COOH یا C₇H₆O₂، یک ترکیب آلی ساده و مهم از خانواده اسیدهای کربوکسیلیک آروماتیک است. این اسید بسیار ضعیف از خانواده کربوکسیلیک اسیدها بوده و به طور طبیعی در بسیاری از گیاهان از طریق فرآیند طبیعی بوجود خواهد آمد، اسید بنزوئیکها به صورت دانههای کریستالی هستند که از نمکهای موجود در آن به عنوان نگهدارنده موادغذایی استفاده میکنند و یکی از مهمترین اسیدها در سنتز مواد آلی به شمار میرود. اسید بنزوئیک به هیچ عنوان در آب سرد حل نمیشود، برای حل شدن آن باید دمای آب را بالا برد تا به طور کامل در آب ترکیب شوند. نام این ترکیب از صمغ بنزوئین گرفته شده که منبع اولیه آن می باشد. کشف اسید بنزوییک متعلق به قرن شانزدهم می باشد، زمانی که نوستراداموس تقطیر خشک صمغ بنزوئین را انجام داد. امروزه، اسید بنزوییک به صورت صنعتی تولید میشود و نقش بسیار مهمی در صنایع غذایی، دارویی و شیمیایی ایفا میکند. این ماده به عنوان یک نگهدارنده طبیعی شناخته میشود و خواص ضدمیکروبی موجود در این ترکیب آن را به یک ماده ضروری تبدیل کرده است.
اسید بنزوییک
فهرست مطالب
Toggleخواص فیزیکی اسید بنزوییک
قبل از خرید بنزوئیک اسید جدول زیر را بررسی کنید
|
خاصیت فیزیکی |
مقدار |
|
فرمول شیمیایی |
C₆H₅COOH (یا C₇H₆O₂) |
|
جرم مولی |
122.123 g/mol |
|
شکل ظاهری |
جامد کریستالی سفید یا بیرنگ با بوی ملایم و خوشایند |
|
ساختار کریستالی |
مونوکلینیک |
|
چگالی |
1.2659 g/cm³ (15°Cدر دمای ) |
|
1.0749 g/cm³ (130°Cدر دمای ) |
|
|
نقطه ذوب |
122.4°C (395 K) |
|
نقطه جوش |
249–250°C (522–523 K) |
|
حلالیت در آب |
1.7 g/L (0°C) |
|
3.44 g/L (25°C) |
|
|
56.31 g/L (100°C) |
|
|
حلالیت در حلالهای آلی |
اتانول : 55.9 g/100 g (دمای اتاق) |
|
متانول: 71.5 g/100 g (23°C) |
|
|
استون، بنزن، کلروفرم، اتر دیاتیل، هگزان: قابل حل |
|
|
فشار بخار |
0.16 Pa (25°C) |
|
ویسکوزیته |
1.26 mPa·s (130°C) |
|
شاخص شکست نور |
1.5397 (20°C) |
|
نقطه اشتعال |
121–124°C (در فشار استاندارد) |
- حلالیت در آب: میزان حلالیت اسید بنزوییک در آب با افزایش دما به طور قابلتوجهی افزایش پیدا می کند، که این ویژگی برای خالصسازی از طریق تبلور دوباره بسیار مفید می باشد.
- حلالیت در حلالهای آلی: اسید بنزوییک در حلالهای آلی قطبی و غیرقطبی به خوبی حل میشود، که آن را برای کاربردهای صنعتی و آزمایشگاهی مناسب میسازد.
- پایداری: این ماده در شرایط معمولی پایدار و غیرفرار بوده و خطر انفجار ندارد.
از نظر شیمیایی، اسید بنزوئیک یک اسید ضعیف به حساب می آید، یعنی وقتی در آب حل میشود، به طور کامل تفکیک نمیشود و فقط بخشی از مولکولهایش به یونهای⁺ Hو بنزوات ⁻ (C₆H₅COO) تبدیل میشوند. این خاصیت باعث میشود که در محیطهای اسیدی بهتر عمل کند، مخصوصا برای جلوگیری از رشد میکروبها وجود این اسید بسیار حائز اهمیت می باشد . قدرت اسیدی این ترکیب (pKa =4.19) کمی بیشتر از اسیدهای ساده مانند اسید استیک است، چون حلقه بنزن آن الکترونها را به سمت خودش میکشد و گروه کربوکسیل را فعالتر میکند.
ساختار اسید بنزوئیک:
این ماده اسیدی، ساختاری مختص به خود دارد که در آن یک حلقه آروماتیک حضور دارد که با یک گروه هیدروکسیل با نماد شیمیایی OH پیوند یگانه داشته و با یک گروه کربونیل پیوند دوگانه داشته است.

مشخصات فنی اسید بنزوئیک
| نام شیمیایی | اسید بنزوئیک | Benzoic acid |
| فرمول شیمیایی | C6H5COOH | C7H6O2 |
| وزن مولکولی | 122.12g/mol |
| نقطه جوش | 249.2 درجه ی سانتی گراد |
| نقطه ذوب | 122.38 درجه ی سانتی گراد |
| شکل ظاهری | جامد و کریستالی |
واکنشهای اصلی اسید بنزوئیک
- تشکیل نمکها: اسید بنزوئیک با مواد قلیایی مثل سدیم هیدروکسید واکنش میدهد و نمکهایی مانند سدیم بنزوات تولید میکند. این نمکها در صنعت غذایی به عنوان نگهدارنده استفاده میشوند.
مثال: C₆H₅COOH + NaOH → C₆H₅COONa + H₂O
- تشکیل استرها: با الکلها در حضور اسید قوی (مثل اسید سولفوریک)، استرهایی مثل متیل بنزوات تولید میکند که در صنعت عطر کاربرد دارند.
مثال: C₆H₅COOH + CH₃OH → C₆H₅COOCH₃ + H₂O
- واکنشهای حلقه بنزن: این حلقه بنزنی در اسید بنزوئیک میتواند در واکنشهایی مثل افزودن گروههای نیترو (-NO₂) یا هالوژن (مثل کلر) شرکت کند، اما این واکنشها معمولاً در شرایط خاصی روی حلقه انجام میشوند، چون گروه کربوکسیل مسیر واکنش را تعیین میکند.
- تبدیل به فنل: در دمای بالا (۲۰۰–۴۰۰ درجه سانتیگراد) و با کمک کاتالیزور ، اسید بنزوئیک میتواند به فنل (C₆H₅OH) تبدیل شود که در تولید پلاستیکها مهم است.
- خاصیت ضدمیکروبی: اسید بنزوئیک به داخل سلولمیکروبها نفوذ میکند و با کاهش pH داخلی سلول، فعالیت آنزیمهایشان را کاهش می دهد. به همین دلیل در غذاهای اسیدی مثل از رشد میکروبها جلوگیری میکند. این خاصیت در محیطهایی با pH کمتر از ۵ بیشتر می باشد.
روش تولید اسید بنزوئیک
تولید صنعتی: رایجترین روش، اکسیداسیون تولوئن (C₆H₅CH₃) با اکسیژن هوا در حضور کاتالیزورهای کبالت یا منگنز است. این فرآیند در دمای ۱۵۰–۲۰۰ درجه سانتیگراد انجام میشود و بازدهی بالایی دارد. محصول جانبی آن آب است، بنابراین روشی نسبتاً سبز است.
روشهای قدیمیتر: در گذشته، بنزوتریکلرید (C₆H₅CCl₃) با هیدروکسید کلسیم واکنش میداد و سپس با اسید به اسید بنزوئیک تبدیل میشد. این روش به دلیل تولید محصولات کلرینه کمتر استفاده میشود.
روشهای آزمایشگاهی: شامل هیدرولیز بنزونیتریل یا بنزامید، اکسیداسیون بنزیل الکل با پرمنگنات پتاسیم، یا کربوکسیلاسیون معرف گریگنارد است. خالصسازی معمولاً با تبلور از آب انجام میشود
علاوه بر اینکه اسید بنزوئیک به طور طبیعی در بسیاری از گیاهان در فرآیندهای سنتر بوجود میآید میتوان آن را از طریق فعالیتهای شیمیایی چون اکسیداسیون جزئی تولوئن با اکسیژن و کاتالیز به وسیله منگنز و نفتالین کبالت به وجود آورد، از این واکنش شیمیایی اسید بنزوئیک حاصل خواهد شد.
راه دیگر ساخت این اسید ضعیف واکنش تریکلروتولوئن با هیدروکسید کلسیم بوده است که در این واکنش شیمیایی آب نقش بسیار مهمی ایفا خواهد کرد به این دلیل که این مواد در برابر ترکیب با آب بنزوات کلسیم را به وجود خواهند آورد.
با استفاده از این دو روش در صنعت میتوان اسید بنزوئیک را تولید کرد البته علاوه بر روشهایی که ذکر شد ترکیبات دیگری چون اکسیداسیون بنزیلکلرید یا بنزیل الکل هم میتوان اسید بنزوئیک را به وجود آورد، اما این آزمایش میتواند درصد خطای بسیار بالایی داشته باشد به همین دلیل است که نمیتوان به آن به عنوان یک راه مطمئن و قطعی نگاه کرد.
کاربرد های اسید بنزوئیک
اسید بنزوییک کاربردهای گستردهای در صنایع دارد. در صنعت غذایی، به عنوان نگهدارنده و نمکهای آن در غذاهای اسیدی مانند نوشابهها، آبمیوهها، مربا، ترشی و سسها استفاده میشود. مقدار میانگین 0.1 الی0.5 درصد است و رشد میکروبها را مهار میکند.
در صنعت شیمیایی، پیشماده برای تولید فنل (از طریق دکربوکسیلاسیون)، کاپرولاکتام (برای نایلون)، ترفتالیک اسید برای PET و پلاستیسازهای بنزوات (جایگزین فتالاتها) است. همچنین، در رزینهای الکید، پوششها و رنگها کاربرد دارد.
در داروسازی، در پمادها برای درمان عفونتهای قارچی پوست (مانند کرم حلقوی) و به عنوان ضدعفونیکننده در تنتور بنزوئین استفاده میشود. به عنوان خلطآور و مسکن به کار میرفت. در لوازم آرایشی، نگهدارنده در کرمها، شامپوها و عطرها است.
کاربردهای دیگر شامل استاندارد کالریمتری، واسطه بیوسنتز در گیاهان، و در صنعت نفت برای جلوگیری از خوردگی است. در کشاورزی، برای کنترل علفهای هرز و در صنایع الکترونیک برای مواد عایق استفاده میشود.
اسید بنزوئیک در مواد غذایی
اسید بنزوئیک از جمله اسیدهایی می باشد که به صورت خوراکی در مواد غذایی مختلف یافت می شود. به عنوان مثال مقدار مختلفی از اسید بنزوئیک در برخی از ادویه ها نظیر دارچین و میخک وجود دارد. همچنین توت ها منبع عظیمی از این نوع اسید هستند، به گونه ای که توت فرنگی از جمله بزرگترین منابع اسید بنزوئیک است. سایر میوه ها همچون سیب و یا آلو خشک شده، حاوی مقادیری از این ماده شیمیایی هستند.
برخی دیگر از مواد غذایی همچون مواد لبنی مثل ماست، شیر و… مقدار کمی از این اسید را در ساختار خود دارند.
از این اسید در تهیه مواد غذایی که نیاز به نگهدارنده دارد استفاده میشود، ازجمله موادغذاییهای کنسرو شده
از این اسید در مواد غذایی رنگی به عنوان یک رنگدهنده مصنوعی استفاده میشود، البته برخی از دانشمندان نگران این مسئله هستند که ممکن است بنزن موجود در اسید بنزوئیک برای سلامتی خطر داشته باشد و در نهایت استفاده مداوم از آن منجر به بیماریهایی چون سرطان شوند.
از اسید بنزوئیک برای ساخت داروهای ضد درد و ضدعفونی کننده استفاده میکنند.
اسید بنزوییک در شرایط محیط به هیچ عنوان واکنش پذیر نخواهد بود و در دمای انبار و فشارهای وارده شرایط بسیار پایدار و با ثباتی خواهد داشت.
اسید بنزوئیک در تولید نایلون
از دیگر کاربردهای اسید بنزوییک در صنعت، می توان و استفاده از آن برای تهیه و تولید نایلون اشاره کرد. در واقع اسید بنزوئیک به طور مستقیم در فرایند تولید نایلون حضور ندارد بلکه در تولید فنل مورد استفاده قرار می گیرد که خود برای تولید نایلون در فرآیندی خاص به سیکلو هگزانول تبدیل می شود.
اسید بنزوئیک در صنعت لوازم آرایشی و بهداشتی
این نوع اسید، ماده ای بسیار کاربردی در صنایع گوناگون می باشد که یکی از آن ها صنعت تولید لوازم آرایشی می باشد. در واقع اسید بنزوئیک به علت خواص و ویژگی های منحصر به فردی که دارد، برای تولید لوازم آرایشی مثل رژ لب مورد استفاده قرار می گیرد.
اسید بنزوئیک برای تولید محصولات مراقبت از دهان استفاده می شود. این اسید یکی از مواد اولیه سازنده دهان شویه ها و خمیر دندان می باشد. چرا که خاصیت ضد عفونی کنندگی دارد.
محصولاتی که برای دفع حشرات مورد استفاده قرار می گیرند، حاوی مقادیری از اسید بنزوئیک هستند.
این ماده کاربردی در تهیه و تولید انواع رنگ ها مورد استفاده قرار می گیرد.
نکات ایمنی، خطرات و نگهداری اسید بنزوئیک
اسید بنزوئیک به شدت ماده اشتعالزایی بوده است به این صورت که در صورت مشتعل شدن آن باید آن را به وسیله پودر و فوم خاموش کرد.
به هیچ عنوان نباید با پوست و چشم برخورد کند به همین دلیل بهتر است در حین کار با این اسید از دستکش و عینک محافظ استفاده کنید، حتی بخار اسید بنزوئیک هم برای چشم ممکن است خطر داشته باشد.
بهترین راه برای نگهداری از آن این است که در بسته بندی اولیه خود به دور از تابش نور مستقیم خورشید نگه داشته شود.
اسید بلو: بررسی خواص، تاریخچه، تولید و کاربردها با تمرکز بر مواد شوینده
اسید بلو (Acid Blue) یک زیر مجموعه از رنگهای اسیدی مصنوعی می باشد که به علت ایجاد رنگ آبی زنده
استایرن: تاریخچه، انواع، کاربردها و روشهای تولید و مسائل زیستمحیطی
استایرن (Styrene) با فرمول شیمیایی C₆H₅CH=CH₂ یکی از مهمترین مونومرهای صنعت پتروشیمی و پلاستیک جهان به حساب می آید. این
بیسفنول A (BPA)
بیسفنول A، ترکیب آلی مصنوعی متعلق به گروه دیفنیلمتانهای مشتقشده و بیسفنولها است که دارای دو گروه هیدروکسیفنیل میباشد. بیسفنول
روانکننده زودگیر بتن
روانکنندههای بتن از مهمترین افزودنیهای شیمیایی در صنعت بتن مدرن به شمار میروند. این مواد با کاهش مقدار آب نسبت






یک نظر در “اسید بنزوئیک چیست؟”